Com sintomas bem parecidos, novos surtos de influenza e Covid-19 deixam a população perdida com tanta semelhança. Os espirros, coriza, garganta com sensação de “arranhão” , dores de cabeça e no corpo, são sintomas comuns nas duas infecções, entretanto existem prescrições de tratamento e temporalidade do isolamento diferentes.
Segundo o infectologista da Fundação Oswaldo Cruz ( Fiocruz) Marcio Nehab, a influenza (gripe) apresenta sintomas bem parecidos com os da Covid-19 e a transmissão ocorre da mesma forma. Os principais sintomas da gripe são: febre; dor de garganta; tosse; dor no corpo; dor de cabeça, calafrios; secreção nasal excessiva e prostração. Quanto à imunização, o especialista ainda destaca: "A imunização é a forma mais eficaz de prevenção contra a gripe e suas complicações. A vacina é segura e é considerada uma das medidas mais eficientes para evitar casos graves e óbitos pela doença. Ela é capaz de promover imunidade durante o período de maior circulação do vírus e a detecção de anticorpos protetores se dá entre duas a três semanas após a vacinação e, em média, confere proteção de seis a doze meses, sendo que o pico máximo de anticorpos ocorre após quatro a seis semanas da vacinação. Além do imunizante, é preciso seguir as regras de proteção de qualquer tipo de infecção respiratória ``, esclarece o médico no portal da fundação.
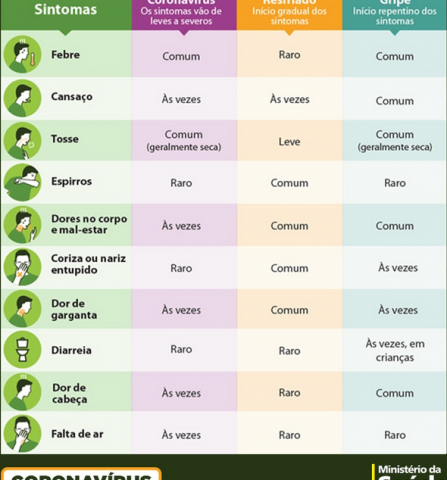
A gripe pode evoluir para casos graves e até mesmo para a morte. Segundo material explicativo do Instituto Fernandes Figueira, da Fundação Oswaldo Cruz (IFF-Fiocruz), a hospitalização e a possibilidade de óbito estão, em geral, vinculadas aos grupos de alto risco.
Com o novo coronavírus e suas variantes, febre e tosse seca são sintomas comuns. Já cansaço, dores no corpo, mal-estar e dor de garganta podem surgir esporadicamente. A doença tem outros sintomas que, em geral, não são sentidos por quem tem gripe, como perda do olfato e paladar.
A transmissão realmente é acentuada no início da infecção, diminuindo bastante após alguns poucos dias —isto é, quando a pessoa é vacinada. Um esclarecimento: o isolamento de cinco dias sugerido pelo Ministério da Saúde é apenas para quem já está sem sintomas de uma infecção respiratória, fez obrigatoriamente o teste e não está com o vírus. Leia, para quem está sem covid-19.
R7