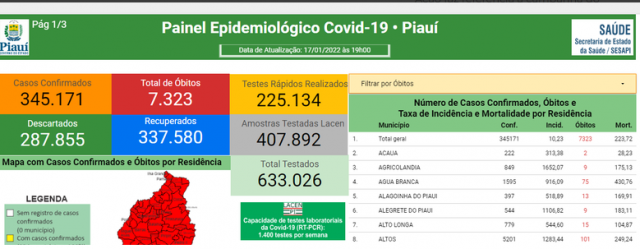
O Governo do Piauí vai distribuir a partir da próxima semana aos municípios novas doses de CoronaVac para a vacinação de crianças. O uso do imunizante contra a Covid-19 foi aprovado para a faixa etária de 6 a 17 anos pela Agência Nacional de Vigilância Sanitária (Anvisa).
A Secretaria de Estado da Saúde (Sesapi) divulgou que possui 100 mil doses da vacina em estoque e que disponibilizará já a partir da próxima segunda-feira (24), 50 mil doses aos municípios para a aplicação da primeira dose. Os outros 50 mil ficarão em estoque para aplicação da segunda dose, por medida de segurança.
O Ministério da Saúde aguarda a publicação oficial da decisão da Anvisa para emitir Nota Técnica sobre o assunto, com as devidas orientações para utilização dos estoques existentes bem como as próximas pautas de distribuição aos estados. Só após a divulgação da nota é que o Piauí começará a aplicar as vacinas.
O imunizante que poderá ser utilizado nas crianças é a mesma formulação disponibilizada para adultos, com a aplicação de duas doses num intervalo de 28 dias entre a primeira e segunda aplicação. “Chamamos atenção para o fato de que as crianças imunossuprimidas devem tomar apenas o imunizante da Pfizer”, destaca Herlon Guimarães, superintendente de Atenção à Saúde e Municípios da Sesapi.
O secretário Florentino Neto recebeu a decisão da Anvisa com otimismo. "Uma notícia alvissareira nesse momento em que precisamos proteger mais e mais pessoas mundo afora. O uso de mais um imunizante para vacinação de nossas crianças vai acelerar o processo de imunização para essa faixa etária ”, afirma o gestor.
Sesapi