 O risco de contágio da covid-19 em escolas não aumenta desde que protocolos de segurança sejam rigorosamentes seguidos, segundo médicos. É mais frequente crianças se infectarem fora do ambiente escolar do que dentro, ressalta o pediatra infectologista Marco Sáfadi, do Hospital Infantil Sabará, em São Paulo.
O risco de contágio da covid-19 em escolas não aumenta desde que protocolos de segurança sejam rigorosamentes seguidos, segundo médicos. É mais frequente crianças se infectarem fora do ambiente escolar do que dentro, ressalta o pediatra infectologista Marco Sáfadi, do Hospital Infantil Sabará, em São Paulo.
"Um dos argumentos para o não retorno às aulas é que representa risco de infecção. Mas estudos feitos em escolas que retornaram as aulas durante a pandemia e rastrearam a origem das transmissões mostraram que era mais frequente crianças se infectarem fora do que dentro da escola. É uma equívoco muito grande não levar crianças à escola, pois elas frequentam outros ambientes que não têm todos os cuidados que a escola implementa e as chances de infecção são maiores", afirma.
Como exemplo de outros ambientes, ele cita restaurantes, clubes e igrejas. "As fontes de infecção, de modo geral, são locais com acúmulo de pessoas, pessoas sem máscara, pouca ventilação e onde ficam por muito", explica. "Qualquer atividade é de risco, algumas de maior outras de menor. A escola não é de maior risco para infecção. Na maioria das vezes, a infecção não ocorre dentro do ambiente escolar", ressalta.
O pediatra Juarez Cunha, presidente da SBIm (Sociedade Brasileira de Imunizações) explica que as experiências que têm sido relatadas por países que já retornaram às aulas é o que risco de contágio não aumenta desde que os protocolos de segurança sejam rigorosamentes seguidos.
"Se as medidas para evitar a transmissão não forem seguidas, como uso de máscara a partir dos dois anos, distanciamento de 1,5m a 2m entre as crianças, lavagem de mãos e evitar aglomeração, o risco de contágio vai existir. O que tem sido relatado é que, quando isso é colocado em prática, a transmissão é evitada, não apenas entre crianças", diz.
Cunha ressalta que, enquanto as aulas não retornam, as crianças estão se infectando como "todas as outras pessoas". "O que temos observado é que, infelizmente, a população não está obedecendo às regras que são básicas e muito simples para evitar a transmissão: uso de máscara, lavagem das mãos, distanciamento social e evitar aglomerações".
Sáfadi explica que a maior transmissão da covid-19 não se dá entre crianças, mas sim a partir de adultos, principalmente de adultos jovens. "A maior transmissão se dá em aqueles que não obedecem às regras, independemente do grupo etário, mas é mais comum a transmissão de adulto para adulto", complementa Cunha.
Risco das novas variantes
As novas variantes do coronavírus do Reino Unido e da África do Sul, já em circulação no Brasil, são mais transmissíveis que o vírus padrão - a do Amazonas ainda está em estudo. No entanto, não há comprovação científica de que sejam mais contagiosas em crianças, reforça Sáfadi. "São interpretações precipitadas".
Cunha destaca que, mesmo assim, as variantes são uma preocupação porque as regras que valiam para o vírus padrão podem não valer mais para as nova variantes, conforme vão sendo estudadas. "Crianças continuam não sendo o grupo de maior risco de doença grave e morte, mas isso não significa que não aconteça com elas", diz.
Mortes em crianças e adolescentes correspondem a 0,6 do total de mortes, apesar de esse grupo representar 25% da população até 19 anos, explica Sáfadi. "Quando há muitos casos e mortes esse número acaba respigando nas crianças. Existe um aumento de mortes onde há mais casos, mas esse aumento está ocorrendo dentro da mesma proporção em crianças", esclarece. Durante um ano de pandemia, houve cerca de 1.200 mortes entre crianças e adolescentes no país, segundo o infectologista.
Cunha frisa que os protolocos de segurança devem ser seguidos no volta às aulas não apenas para proteger as crianças, mas também os profissionais que trabalham na escola. "São grupos que estão na estratégia de vacinação, mas vai demorar para serem vacinados. Esse retorno tem que ser seguro para professores e outros trabalhadores da escola", finaliza.
R7
Foto: IBRAHEEM ABU MUSTAFA/REUTERS














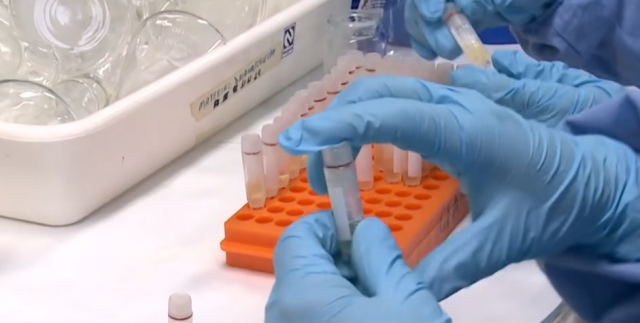 Especialistas que acompanham a evolução do novo coronavírus afirmam que a variante chamada de P.1, identificada em Manaus no começo do ano, tem potencial para infectar pessoas que já tiveram a Covid-19. Entretanto, a análise exige cautela e os pesquisadores aguardam estudos conclusivos.
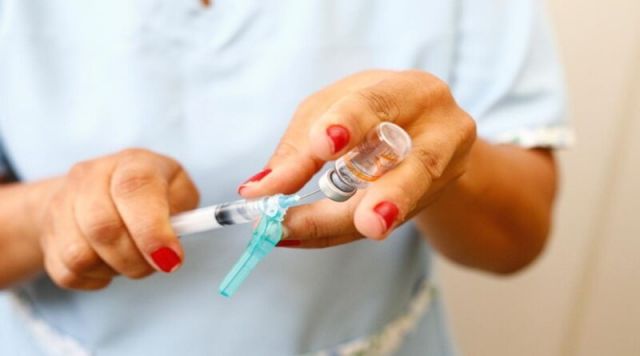
Especialistas que acompanham a evolução do novo coronavírus afirmam que a variante chamada de P.1, identificada em Manaus no começo do ano, tem potencial para infectar pessoas que já tiveram a Covid-19. Entretanto, a análise exige cautela e os pesquisadores aguardam estudos conclusivos.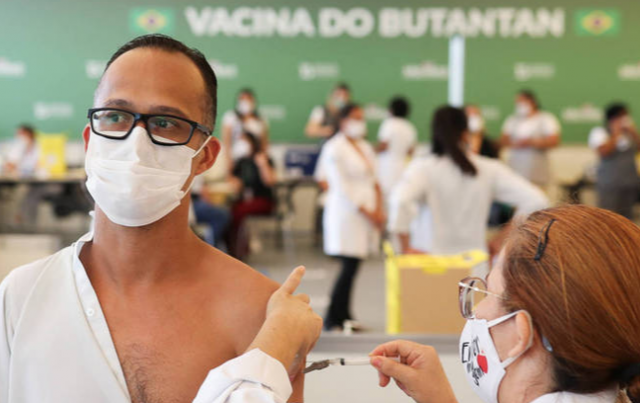 A Anvisa (Agência Nacional de Vigilância Sanitária) emitiu um alerta na terça-feira (26) sobre os cuidados para administrar a CoronaVac, que vem em um frasco multidose de 5 ml com 10 doses de vacina, a fim de prevenir erros.
A Anvisa (Agência Nacional de Vigilância Sanitária) emitiu um alerta na terça-feira (26) sobre os cuidados para administrar a CoronaVac, que vem em um frasco multidose de 5 ml com 10 doses de vacina, a fim de prevenir erros.