 Cientistas do Wynn Institute, ligado à Universidade de Harvard, nos Estados Unidos, conseguiram resultados promissores em uma potencial vacina contra alguns tipos de câncer.
Cientistas do Wynn Institute, ligado à Universidade de Harvard, nos Estados Unidos, conseguiram resultados promissores em uma potencial vacina contra alguns tipos de câncer.
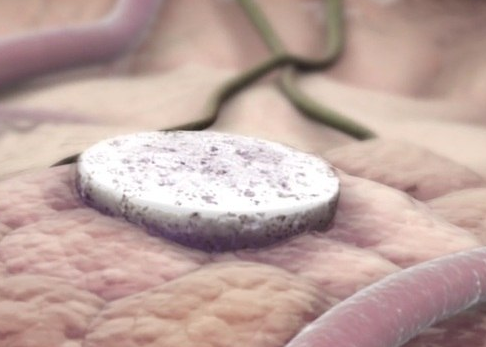
O estudo, publicado nesta semana na revista científica Nature Communications, mostra que o pequeno disco desenvolvido foi capaz de prevenir a recidiva de tumores em camundongos.
A vacina é um biomaterial do tamanho de um comprimido (8 mm x 2 mm) que foi idealizado para ser implantado na área onde o paciente já teve um tumor prévio, como de mama, por exemplo.
Essa esponja é implantada sob a pele e projetada para recrutar e reprogramar as células imunológicas do próprio paciente "no local", instruindo-as a viajar pelo corpo, alojar-se nas células cancerosas e, em seguida, matá-las.
Segundo o Wynn Institute, a potencial vacina reúne o poder de dois dos tratamentos muito usados contra o câncer: a quimioterapia e a imunoterapia.
Ao mesmo tempo em que tem a capacidade de matar as células cancerígenas (quimioterapia), ela também tem o efeito de longo prazo da imunoterapia.
"Quando camundongos com câncer de mama triplo-negativo agressivo (TNBC) receberam a vacina, 100% deles sobreviveram a uma injeção subsequente de células cancerosas sem recidiva", diz o estudo.
Um dos autores do estudo, Hua Wang, ressaltou a importância desse tipo de tecnologia para o tratamento de alguns tipos de tumores malignos cujos tratamentos disponíveis hoje não têm tanta eficácia.
“O câncer de mama triplo-negativo não estimula respostas fortes do sistema imunológico, e as imunoterapias existentes não conseguiram tratá-lo. Em nosso sistema, a imunoterapia atrai várias células imunológicas para o tumor, enquanto a quimioterapia produz um grande número de fragmentos de células cancerosas mortas que as células imunológicas podem pegar e usar para gerar uma resposta eficaz e específica contra o tumor."
Embora otimistas, os estudos para esse tipo de antígeno ainda precisam de mais respostas e devem continuar pelos próximos anos. Os cientistas pretendem explorar combinações de quimioterapia com vacinas contra o câncer para melhorar a resposta antitumoral em casos de difícil tratamento.
O diretor-fundador do Wyss Institute, Don Ingber, comemorou o avanço da potencial vacina e disse que ela "oferece uma nova esperança para o tratamento de uma ampla gama de cânceres".
"É uma forma inteiramente nova de quimioterapia combinada que pode ser administrada por meio de uma única injeção e potencialmente oferece maior eficácia com toxicidade muito menor do que os tratamentos convencionais usados hoje."
R7
Foto: Divulgação/Wynn Institute














 Pessoas que usam máscaras com válvulas podem estar mais protegidas de contraírem o coronavírus, mas se já estiverem infectadas, vão espalhá-lo com mais facilidade no ar.
Pessoas que usam máscaras com válvulas podem estar mais protegidas de contraírem o coronavírus, mas se já estiverem infectadas, vão espalhá-lo com mais facilidade no ar. A Anvisa autorizou nesta quarta-feira, 11, a retomada do estudo clínico da CoronaVac. O estudo foi suspenso na segunda-feira, 9, a noite, após a agência ter sido notificada de um evento adverso grave (morte) com um voluntário do estudo. No entanto, desde o primeiro momento o Instituto Butantan, responsável pela pesquisa no Brasil, afirmou que o evento adverso grave em questão não estava, em hipótese alguma, associado à vacina.
A Anvisa autorizou nesta quarta-feira, 11, a retomada do estudo clínico da CoronaVac. O estudo foi suspenso na segunda-feira, 9, a noite, após a agência ter sido notificada de um evento adverso grave (morte) com um voluntário do estudo. No entanto, desde o primeiro momento o Instituto Butantan, responsável pela pesquisa no Brasil, afirmou que o evento adverso grave em questão não estava, em hipótese alguma, associado à vacina. A Anvisa (Agência Nacional de Vigilância Sanitária) suspendeu nesta segunda-feira (9) os estudos com a vacina Coronavac, imunizante contra a covid-19 parceria entre o governo do estado de São Paulo e o laboratório chinês Sinovac. A medida foi feita após uma ocorrência de "evento adverso grave".
A Anvisa (Agência Nacional de Vigilância Sanitária) suspendeu nesta segunda-feira (9) os estudos com a vacina Coronavac, imunizante contra a covid-19 parceria entre o governo do estado de São Paulo e o laboratório chinês Sinovac. A medida foi feita após uma ocorrência de "evento adverso grave".