 Pesquisadores da Fiocruz (Fundação Oswaldo Cruz) alertam que é possível uma retomada no crescimento de casos de SRAG (Síndrome Respiratória Aguda Grave), frequentemente relacionados à covid-19. Segundo Boletim InfoGripe divulgado nesta 6ª feira (12.ago.2021), foi identificada uma interrupção na tendência de queda dos casos e mortes relacionados à síndrome. Desde 2020, 71% dos casos de SRAG foram causados por vírus respiratórios no país e, entre eles, o SARS-CoV-2 responde por 96,6%.
Pesquisadores da Fiocruz (Fundação Oswaldo Cruz) alertam que é possível uma retomada no crescimento de casos de SRAG (Síndrome Respiratória Aguda Grave), frequentemente relacionados à covid-19. Segundo Boletim InfoGripe divulgado nesta 6ª feira (12.ago.2021), foi identificada uma interrupção na tendência de queda dos casos e mortes relacionados à síndrome. Desde 2020, 71% dos casos de SRAG foram causados por vírus respiratórios no país e, entre eles, o SARS-CoV-2 responde por 96,6%.
O estado do Rio de Janeiro é o único a apresentar uma forte probabilidade (95%) no crescimento de casos de SRAG quando são analisadas as últimas 6 semanas. Essa é a 1ª vez em que essa tendência é detectada no estado, que concentra o maior número de casos confirmados da variante delta no Brasil.
Os estados de Mato Grosso do Sul e Acre também apresentam tendência de crescimento nesse tipo de análise, com probabilidade de 75%. Na análise de curto prazo (últimas 3 semanas), Mato Grosso do Sul apresenta forte probabilidade de crescimento, e também tendem a crescer a Bahia, Sergipe, Rio de Janeiro, São Paulo, Paraná e Rio Grande do Sul.
Pesquisadores usam a análise de 6 semanas para uma avaliação da tendência de casos de SRAG com menor peso de oscilações semanais. Já a de 3 semanas, apesar de conter mais oscilações, indica possíveis alterações no comportamento de longo prazo.
Modificações de tendência foram percebidas no Paraná, Rio Grande do Sul e em São Paulo, onde foi observado sinal de estabilidade na tendência de longo prazo e sinal moderado de crescimento na tendência de curto prazo. Já na Bahia e em Sergipe, observa-se sinal de queda no longo prazo, com sinal moderado de crescimento na tendência de curto prazo.
Sinais de estabilidade nas tendências de curto e longo prazo foram registrados no Amazonas, Ceará, Distrito Federal, Espírito Santo, Minas Gerais, Pernambuco, Rondônia e Santa Catarina. Já Pará, Roraima, Maranhão, Tocantins e Alagoas apresentam tendência de queda nas duas análises.
Quando se concentra nas capitais, a pesquisa mostra que há 9 com tendência de queda no longo prazo. Florianópolis registra sinal forte de crescimento na tendência de longo prazo e moderado na de curto prazo. Já Porto Alegre e Rio de Janeiro apresentam sinal moderado de crescimento tanto no curto quanto no longo prazo.
Há indicativos de estabilização nas tendências de longo e curto prazo em Belém (PA), Belo Horizonte (MG), Plano Piloto de Brasília e arredores (DF), Fortaleza (CE), Goiânia (GO), Macapá (AP), Manaus (AM), Porto Velho (RO), Recife (PE) e Vitória (ES).
Com informações da Agência Brasil.
Foto: iktor Forgacs (via Unsplash)














 Pesquisadores brasileiros encontraram uma nova versão da variante Gama do coronavírus, identificada em janeiro em Manaus (AM). A cepa chamada de Gama plus é descrita em um trabalho feito pelo projeto Genov, da rede de laboratórios Dasa.
Pesquisadores brasileiros encontraram uma nova versão da variante Gama do coronavírus, identificada em janeiro em Manaus (AM). A cepa chamada de Gama plus é descrita em um trabalho feito pelo projeto Genov, da rede de laboratórios Dasa.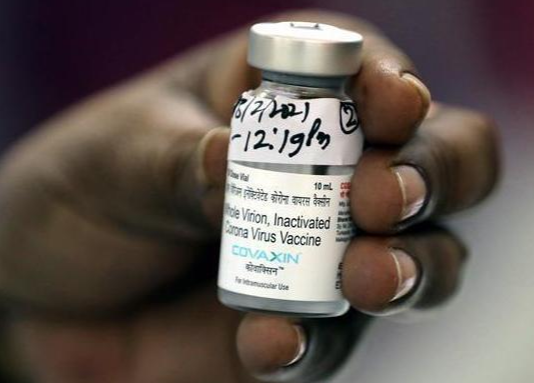 A vacina contra a covid-19 Covaxin, desenvolvida pelo laboratório indiano Bharat Biotech, está sendo analisada por especialistas da OMS (Organização Mundial da Saúde), que podem aprovar o uso emergencial dela em setembro, anunciou nesta quarta-feira (11) uma responsável pela agência em Genebra.
A vacina contra a covid-19 Covaxin, desenvolvida pelo laboratório indiano Bharat Biotech, está sendo analisada por especialistas da OMS (Organização Mundial da Saúde), que podem aprovar o uso emergencial dela em setembro, anunciou nesta quarta-feira (11) uma responsável pela agência em Genebra. Dados de uma pesquisa feita pelo Hospital das Clínicas (HC) apontam que cerca de 70% dos pacientes que tiveram covid-19 um ano após alta hospitalar apresentam algum tipo de sequela. Entre os casos analisados foram relatados episódios de fraqueza, fadiga e falta de ar, entre outros. A pesquisa foi feita através do acompanhamento de pacientes que foram internados no HC.
Dados de uma pesquisa feita pelo Hospital das Clínicas (HC) apontam que cerca de 70% dos pacientes que tiveram covid-19 um ano após alta hospitalar apresentam algum tipo de sequela. Entre os casos analisados foram relatados episódios de fraqueza, fadiga e falta de ar, entre outros. A pesquisa foi feita através do acompanhamento de pacientes que foram internados no HC.