O Instituto Butantan vai comercializar a vacina contra chikungunya, desenvolvida em parceria com a farmacêutica franco-austríaca Valneva, para países de baixa e média renda. Segundo o diretor do Instituto, Esper Kallás, a distribuição será feita após o registro da Anvisa (Agência Nacional de Vigilância Sanitária), esperado para ser liberado ainda neste semestre.
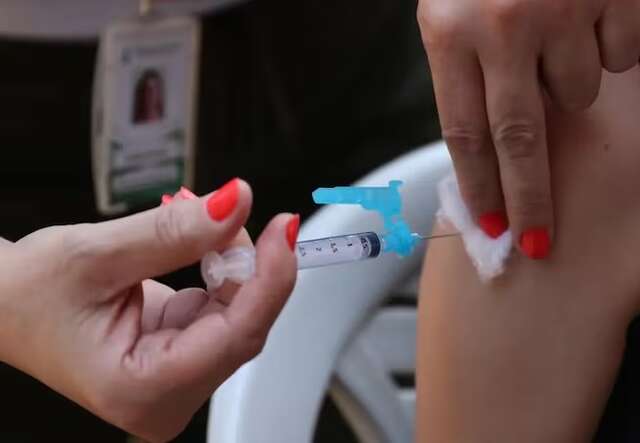
O imunizante, que mostrou uma eficácia de 98,8%, foi o primeiro aprovado no mundo e já foi registrado por agências reguladoras dos Estados Unidos, Europa e Canadá. “O Butantan vai comercializar a vacina em todo o mercado de baixa e média renda no mundo, se posicionando como uma empresa internacional para cumprir um papel social muito importante para a saúde pública”, disse Kallás.
Apenas este ano, o Brasil registrou 257.736 casos prováveis da doença, segundo dados do Ministério da Saúde, atualizados nesta quarta-feira (25). No período, 177 mortes por chikungunya foram confirmadas e 142 estão em investigação.
Transmitida pelo mosquito Aedes aegypti, a doença causa, principalmente, febre, dores nas articulações e musculares, machas vermelhas pelo corpo e coceira na pele. O diagnóstico da doença pode ser confirmado por exames laboratoriais, que estão disponíveis no SUS (Sistema Único de Saúde).
Outras vacinas Durante a palestra, feita no Congresso da Sociedade Brasileira de Medicina Tropical, o diretor do Instituto falou, ainda, que o Butantan mira na preparação contra futuras pandemias. Desde 2023, o Instituto vem desenvolvendo uma vacina contra a gripe aviária, devido ao aumento da circulação da doença em aves.
“Nosso objetivo é responder às necessidades que o Brasil pode enfrentar no futuro, em virtude de uma possível pandemia de gripe aviária. A Covid-19 deixou claro que é preciso criar infraestrutura e capacidade interna para reagir a outras ameaças que virão”, afirmou.
Após a análise de sequências virais disponíveis, pesquisadores realizaram os lotes de trabalho, provas de conceito, lotes de produção e controle e avaliação de qualidade. A partir disso, em agosto, o Butantan submeteu à Anvisa um pedido para iniciar a fase 1/2 do estudo da vacina em humanos.
Agência Brasil
Foto: Reprodução/José Cruz/Agência Brasil/Arquivo















